细胞基因过表达
细胞基因过表达的含义
泰斯拓采用第三代慢病毒(VSV-G 包膜)系统,将目的基因(ORF/cDNA/突变体)永久整合至宿主基因组,经抗性筛选 + 单克隆扩增,获得表达稳定、传代无忧的过表达稳转株。每株细胞均通过 RT-qPCR 定量表达、WB 验证蛋白水平,并出具无菌、支原体、STR 全套 QC 报告,可直接用于功能研究、抗体筛选及动物模型。
工具载体介绍
根据实验需要不同,目的基因大小等选择不同的载体,包括真核表达载体和病毒载体等均可以实现编码基因和非编码基因的过表达。
| 表达系统 | 真核表达载体 | 慢病毒载体 | 重组腺相关病毒载体 | 重组腺病毒载体 |
|---|---|---|---|---|
| 载体基因特性 | 双链DNA质粒 | RNA逆转录病毒 | 单链DNA病毒 | 双链DNA病毒 |
| 外源基因表达时间 | 24h开始表达,持续3-7天 | 2-4天开始表达,长时间稳定表达 | 7-14天开始表达 | 1-2天开始表达 |
| 插入片段大小 | 8kb左右 | 4kb左右 | 2.8kb左右 | 4kb左右 |
| 稳定细胞株筛选 | 难操作 | 可以 | 不可以 | 不可以,瞬时表达 |
| 细胞实验 | 细胞系,部分转染效率低 | 首选,广谱,感染效率高 | 细胞系,部分血清型转染效率低 | 广谱,感染效率高 |
| 动物实验 | 不适合 | 适合,根据观察时间和注射部位 | 首选,根据观察时间和注射部位 | 免疫原性高,慎选 |
| 滴度范围 | 无 | 108~109TU/ml | 1012-1013VG/ml | 1010-1011PFU/ml |
载体图谱中常见元件介绍
| 元件名称 | 类型 | 用途 |
|---|---|---|
| 启动子 | CMV、CAG、EF1a、U6等 | 广谱或特异启动目的基因的表达 |
| hSyn、CaMKIIα等 | 特异性启动子,在特定的组织细胞中启动目的基因的表达 | |
| 蛋白标签 | 3xFLAG、HA 、6xHis、Myc等 | 与目的基因融合表达,常用于检测外源蛋白表达水平 |
|
荧光标记 |
EGFP、mCherry、mNeonGreen等 |
可与目的基因融合或非融合表达用于检测转染、感染效果 |
| 抗性基因 |
Puro、Neo、Hygro、BSD等 |
真核抗性,常用于稳定株筛选 |
|
Amp、Kan |
原核抗性,常用于原核细菌培养,质粒扩增 |
|
| 连接元件 |
Linker |
用于连接两个基因,融合表达时常用,可降低因融合表达对蛋白折叠和功能的影响 |
| IRES、2A |
用于连接两个基因,达到非融合表达的效果 |
|
| 其它元件 | WPRE | 增加目的基因的表达 |
常用的细胞基因过表达方法
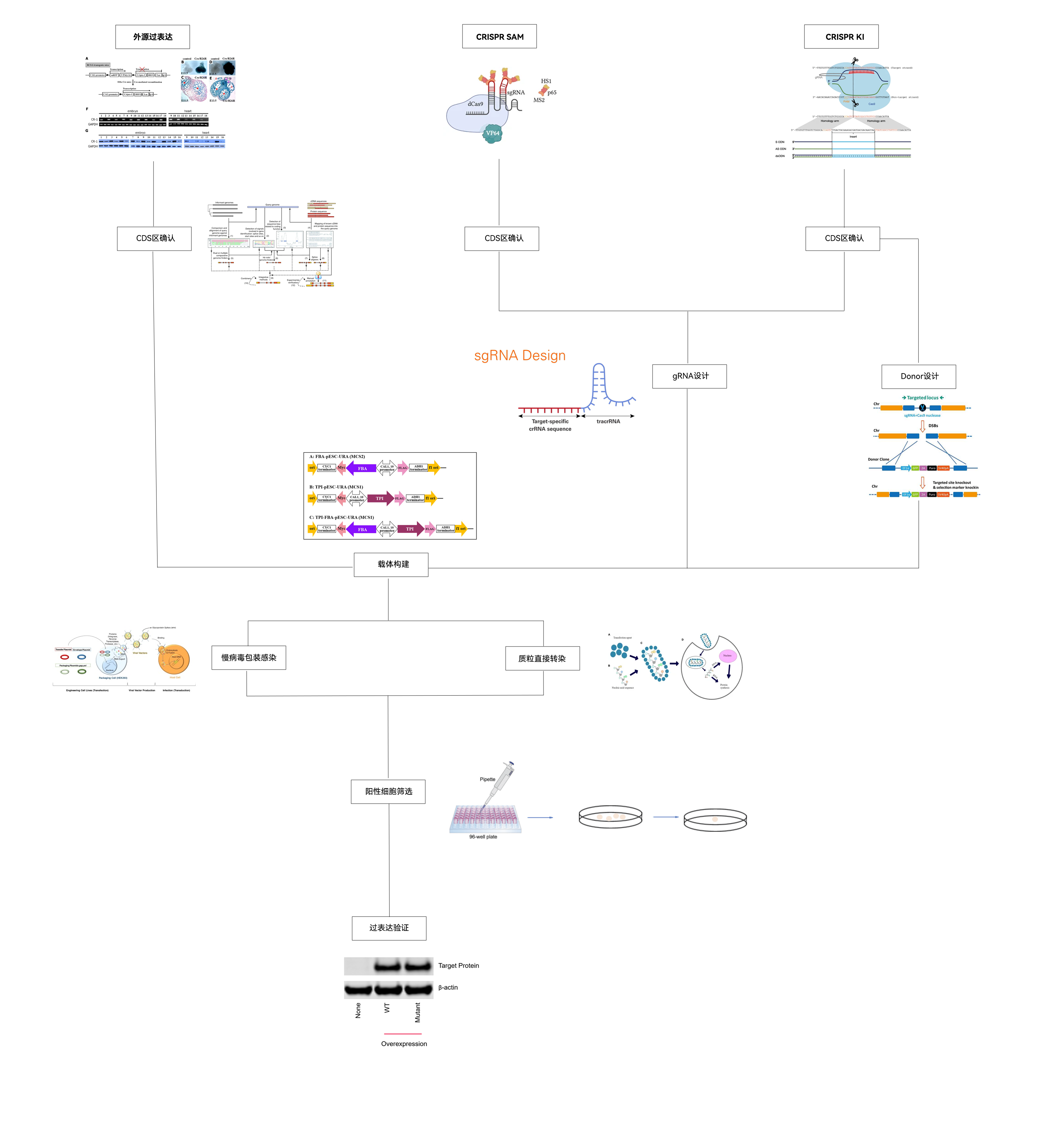
| 方案 | 外源过表达 | CRISPR SAM | CRISPR KI |
|---|---|---|---|
| 载体 | 病毒/质粒 | 病毒/质粒 | 病毒/质粒 |
| 优势 | 适用范围广,操作简单 | 不引入外源基因,可对多种蛋白进行过表达 | 操作简单,对原基因序列改变小 |
| 劣势 | 无法表达大片段 | 操作复杂,成本和周期长,仅可过表达内源基因 | 仅可过表达内源基因,可能要进行多轮验证 |
服务流程及方案适配
FAQs
1. 基因过表达和基因敲入这两种方法的优缺点有哪些?
| 维度 | 基因过表达(随机整合) | 基因敲入(定点整合) |
|---|---|---|
| 原理 | 慢病毒/转座子随机插入基因组,强启动子驱动 cDNA | CRISPR + Donor 将目标序列精准插入指定“安全港”位点 |
| 优点 | ① 技术成熟,2 周出稳转池 ② 载体构建简单,成本低 ③ 表达量高,可多级放大 | ① 单拷贝插入,无位置效应,表达均一 ② 可带内源启动子/3’UTR,生理水平表达 ③ 符合 FDA 申报要求,适合临床前 |
| 缺点 | ① 插入位点随机,可能沉默或激活旁路基因 ② 传代 >30 代表达可能下降 ③ 不适合体内基因治疗申报 | ① 需同步做CRISPR切割+HDR,周期长3-4周 ② 难转染细胞HDR效率低,需病毒型Donor ③ 成本高于随机整合 |
| 泰斯拓提速 | VSV-G 慢病毒 + H+ 增强子,表达提升 5-8 倍 | HZ-HRex™ 平台 HDR 效率 60-84%,不成功不收费 |
2.慢病毒转导和质粒转染这两种方法的优缺点有哪些?
| 维度 | 慢病毒转导 | 质粒转染 |
|---|---|---|
| 原理 | 病毒包膜与细胞膜融合,RNA 逆转录后整合基因组 | 脂质体/电穿孔将 DNA 瞬时导入胞浆,不整合 |
| 优点 | ① 感染效率高(悬浮、原代、难转染细胞 >80%) ② 永久整合,可传代 >30 代 ③ 可做多基因共感染 | ① 实验周期短(24 h 可见表达) ② 无病毒序列,适合瞬时功能挽救 ③ 载体容量大(>10 kb) |
| 缺点 | ① 需 BSL-2 实验室,操作繁琐 ② 插入位点随机,潜在激活旁路基因 ③ 包装容量受限(<6 kb) | ① 瞬转 3-7 d 表达骤降,需反复转染 ② 电转对细胞毒性大,原代细胞死亡率高 ③ 难获均一高表达群体 |
| 泰斯拓方案 | 第三代自灭活病毒 + VSV-G 广谱包膜,滴度 1×10⁸ TU/ml | mRNA 电转替代 DNA,毒性降 50%,表达 48 h 达峰 |







